A luz é produzida quando elétrons vibram, indo e voltando rapidamente entre vários níveis de energia que existem na eletrosfera de um átomo. Para cada salto, é emitido um fóton, que é uma luz monocromática, de comprimento de onda (cor) bem definido.
Deste fato resultam os espectros de emissão, formados por raias ou bandas coloridas, que servem inclusive, para identificar o átomo emissor da luz. Em temperaturas elevadas átomos com muitos elétrons emitem tantas raias que o espectro se torna contínuo e a presença simultânea de todas as cores se traduz na cor branca. Um objeto é branco quando reflete todas as cores. Um objeto é preto quando absorve todas as cores. Um objeto é vermelho quando reflete a cor vermelha e absorve as demais cores.  |
Esse blog tem como finalidade, aborda temas de interesses sociais a respeito da química, visando também o aperfeiçoamento no ambiente escolar. "[...] e eu que pensava que química era difícil, me enganei, pois cálculos estequiométricos são mais fáceis de resolver do que divisões do coração." Débora Comis
segunda-feira, 17 de fevereiro de 2014
Por que nosso mundo é colorido?
Por que não devemos descartar Pilhas e baterias em lixo comum?
O grande aumento do uso de celulares, computadores, filmadoras, aparelhos de som e tantos outros aparelhos eletrônicos ocasionou o aumento também muito elevado de pilhas e de baterias.


Muitas destas pilhas e baterias são feitas de metais pesados como mercúrio, cádmio, níquel e substâncias que contém estes metais. Estas substâncias são muito tóxicas e prejudicam o organismo. Tem efeito cumulativo. Dependendo da concentração, podem causar, a longo prazo, doenças no sistema nervoso, nos rins, nos ossos, etc. Pode causar inclusive câncer.
O perigo deste material é a forma com que é descartado. Muitas vezes de forma inadequada. Geralmente vão parar nos lixões comuns. Com o passar do tempo, as pilhas e as baterias descartadas deixam vazar líquidos que contaminam o solo, os lençóis freáticos, e que podem até chegar aos rios e lagos.
Por este motivo, devemos descartar pilhas e baterias em locais apropriados ondem fazem a coleta deste material para a reciclagem e não nos lixos comuns.
O perigo deste material é a forma com que é descartado. Muitas vezes de forma inadequada. Geralmente vão parar nos lixões comuns. Com o passar do tempo, as pilhas e as baterias descartadas deixam vazar líquidos que contaminam o solo, os lençóis freáticos, e que podem até chegar aos rios e lagos.
Por este motivo, devemos descartar pilhas e baterias em locais apropriados ondem fazem a coleta deste material para a reciclagem e não nos lixos comuns.

fonte:http://www.soq.com.br/curiosidades/c44.php
LINUS PAULING E A VITAMINA C
O químico americano Linus Carl Pauling foi um importante cientista e obteve durante sua carreira dois prêmios Nobel.
Em 1954, recebeu o Prêmio Nobel de Química por descobertas na área de ligações químicas. Este trabalho foi muito útil para descrever a estrutura e a forma dos átomos e das complexas moléculas de tecidos vivos.
Em 1962, recebeu o Prêmio Nobel da Paz, por sua luta contra a proliferação de armas atômicas.

A vitamina C foi descoberta em 192 por outro cientista, mas foi Pauling quem descobriu a importância desta vitamina no tratamento da gripe.
Aos 41 anos de idade, descobriu uma doença nos rins, a Doença de Bright. Era considerada uma doença incurável na época. Tratou-se com um médico que indicava maior consumo de vitaminas e sais minerais e pouca ingestão de sal e proteínas.
Em suas pesquisas, investigava a ação de enzimas e deu-se conta que as vitaminas podiam ter efeitos bioquímicos no organismo. Em 1968, Linus pauling publicou um artigo sobre psiquiatria ortomolecular. Suas ideias não eram aceitas.
Um outro cientista apresentou a tese de que podia haver cura de doenças a base de altas doses de vitamina C. Assim, Pauling começou a ingerir vários gramas de vitamina C para prevenir resfriados. Estudou muito sobre o assunto: “Vitaminas e resfriado comum”.
 
Laranja e Kiwi: frutas que contêm vitamina C.
Trabalhou com um oncologista para estudar a relação da vitamina C com o câncer. Publicaram muitos artigos juntos. Ainda era muito criticado pelas pesquisas.
Desenvolveu dietas a base de elevadas doses de vitamina C como tratamento complementar contra o cancro. A ideia era usar a vitamina de forma prolongada para prevenir várias doenças.
Fundou um Intituto para continuar as investigações sobre a vitamina C. Estudou, nos seus últimos anos de vida sobre a ação da vitamina em agumas doenças.
Morreu aos 93 anos em 1994.

Desde 1966, Pauling tomava todos os dias 18g de vitamina C e em 1991 quando descobriu um câncer, ele sustentou a tese de que a vitamina C foi quem retardou o aparecimento da doença pelo menos 20 anos. Enquanto isso, todos achavam que ele estava com câncer, justamente porque tomava altas doses de vitamina C.
fonte: http://www.soq.com.br/curiosidades/c51.php
|
Energia Química do corpo

Nos exercícios que praticamos liberamos energia do corpo
Qual energia é responsável pela manutenção da vida? A energia química é aquela proveniente da quebra de ligações entre átomos, e essa energia é que nos mantêm vivos.
Para um melhor entendimento comecemos por definir o que são reações químicas. As reações responsáveis pela quebra ou formação de ligações entre átomos se fazem presentes dentro de nosso corpo, estão nas células e a partir delas é que a estrutura corporal é construída.
Algumas funções corporais como: processo de cicatrização, formação dos dentes, crescimento de cabelos e unhas, todos são provindos das reações de absorção de energia. Por outro lado, o aquecimento corporal que nos permite a proteção contra o frio, é conseqüência das reações químicas que liberam energia. É justamente por esta energia que se torna possível a vivência em lugares gélidos, como nos pólos norte e sul.
Para um melhor entendimento comecemos por definir o que são reações químicas. As reações responsáveis pela quebra ou formação de ligações entre átomos se fazem presentes dentro de nosso corpo, estão nas células e a partir delas é que a estrutura corporal é construída.
Algumas funções corporais como: processo de cicatrização, formação dos dentes, crescimento de cabelos e unhas, todos são provindos das reações de absorção de energia. Por outro lado, o aquecimento corporal que nos permite a proteção contra o frio, é conseqüência das reações químicas que liberam energia. É justamente por esta energia que se torna possível a vivência em lugares gélidos, como nos pólos norte e sul.
fonte: http://www.brasilescola.com/quimica/energia-quimica-corpo.htm
Condicionadores

Os condicionadores eliminam ou, pelo menos, reduzem a repulsão dos fios carregados negativamente, tornando mais fácil penteá-los
Os condicionadores capilares, independente da marca, sempre possuem como composto principal um tensoativo catiônico. Agentes tensoativos ousurfactantes são compostos que têm a capacidade de diminuir a tensão superficial da água. Além disso, suas moléculas são caracterizadas por uma longa cadeia apolar e um grupo funcional polar. A parte ativa da molécula dos condicionadores é um cátion (─NH3+):
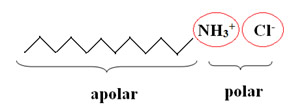
Os detergentes (compostos que limpam especialmente sujeiras de óleo e graxa), incluindo o xampu, são também tensoativos, porém, do tipo aniônico. Assim, quando a pessoa utiliza o xampu, seu cabelo fica eletrostaticamente carregado, em razão da repulsão entre as moléculas negativas carregadas, aderidas ao cabelo. Os fios carregados negativamente repelem-se, embaraçando-se uns nos outros e adquirindo um aspecto áspero e arrepiado.
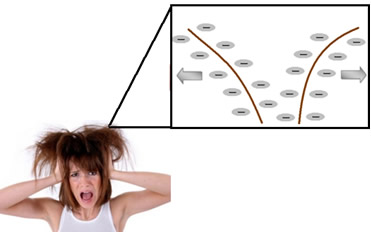
Por isso, é necessário passar o condicionador depois de lavar os cabelos com xampu. Geralmente, esse composto apresenta na sua composição surfactantes de sais quaternários de amônio, pois ele apresenta quatro grupos ligados ao nitrogênio com carga positiva. Abaixo é mostrado o mais usado:
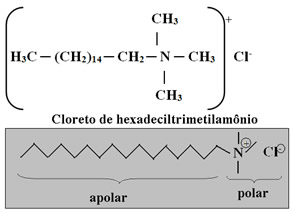
Por apresentar cargas positivas, o condicionador neutraliza as cargas negativas depositadas nos cabelos pelo xampu, diminuindo a repulsão entre os fios. Os íons carregados positivamente aderem aos fios (e também aos tecidos), formando uma camada uniforme que tem forte atração pela água. É por isso que os fios ficam mais úmidos, reduzindo a fricção dos fios, tornando-os mais fáceis de pentear. Os tensoativos catiônicos também possuem grande afinidade com a queratina dos fios do cabelo, tornando-os mais macios e brilhosos.
Os tensoativos catiônicos possuem ação bactericida. Por serem irritantes à pele, eles não são usados em produtos para o corpo, mas somente em cremes para os cabelos e amaciantes de roupas.
Segundo a legislação brasileira, os amaciantes de roupas e condicionadores de cabelos (detergentes catiônicos) devem apresentar o limite mínimo de pH de 3,0 (ácido).
Fonte:
http://www.brasilescola.com/quimica/condicionadores.htm
Bola de futebol: do capotão ao poliuretano

O que torna a bola de futebol resistente?
Começa a partida e lá está ela: no centro do estádio, em poucos segundos já recebe o pontapé inicial e daí por diante os chutes se tornam frequentes. São vários passes entre empurrões, dribles, faltas, tudo para colocá-la em único lugar, no GOOOOOOOL!!!
Sabe de quem estamos falando? Da bola de futebol, a parceira nº 1 de craques como Pelé, Maradona, Zico, Ronaldo, Kaká, etc.
Sabe de quem estamos falando? Da bola de futebol, a parceira nº 1 de craques como Pelé, Maradona, Zico, Ronaldo, Kaká, etc.
Afinal, o que torna esse objeto esportivo capaz de receber inúmeros pontapés e se manter rolando pelo campo elegantemente? A busca pela resistência do símbolo do futebol começou no século passado. Acompanhe agora a evolução da bola de futebol, como diferentes materiais foram sendo testados para sua fabricação, tudo para que não sofresse alteração de peso, medida e formato durante a partida.
.jpg)
Bolas antigas e modernas
• No ano de 1884, Charles Miller trouxe da Inglaterra a primeira bola a rolar nos campos de futebol brasileiro. A matéria-prima usada era origem animal, as bolas eram feitas de couro curtido (o famoso capotão) e a câmara de ar era uma bexiga de boi.
• Em 1958, na primeira Copa do Mundo em que o Brasil foi campeão, a bexiga de boi deu lugar à câmara de ar de borracha. Mas em dias chuvosos eis o problema: os campos ficavam cheios de lama e as bolas, ainda feitas de couro, se encharcavam chegando a pesar o dobro do normal.
• Ainda em 1970, no ano em que o Brasil se tornou tricampeão, as bolas continuavam a ser de couro.
• Só em 1994 as bolas começaram a ficar mais leves, graças à presença de polímeros. O poliuretano (altamente durável e leve) foi usado como revestimento e nas camadas internas se empregou o poliestireno, as câmaras eram de látex. Foi chutando esta bola que o Brasil chegou ao tetracampeonato da Copa Mundial, nesse mesmo ano.
• Já na Copa do ano de 2002, mais polímeros fizeram parte da confecção da bola: sob o revestimento de poliuretano se empregou dez camadas de poliestireno e na câmara foi usada a borracha butílica. Outro polímero, o Kevlar, foi usado para costurar a bola.
• Em 2004 a tecnologia chegou para inovar. Os gomos da bola utilizada nas Olimpíadas de Atenas eram unidos por ligação térmica em vez de costuras.
fonte:http://www.brasilescola.com/quimica/bola-futebol-capotao-ao-poliuretano.htm
Airbag e reação de decomposição
A reação presente no airbag produz gás nitrogênio e silicato alcalino
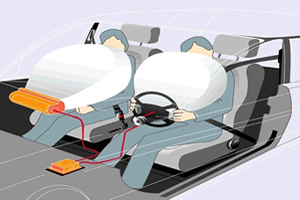
O airbag é um dispositivo destinado a proteger motoristas e passageiros em caso de colisão. Para haver um perfeito funcionamento, o sistema envolve os seguintes mecanismos:
- sensores localizados na parte frontal do veículo;
- um dispositivo onde há substâncias químicas que reagem entre si quando recebem um impulso elétrico;
- uma bolsa plástica que fica acondicionada dentro do ponto central do volante de direção. No caso do passageiro, a bolsa está localizada no painel logo acima do porta-luvas.
Mas como a bolsa plástica se enche subitamente no caso de uma colisão? E de onde vêm os 70 litros de ar que faz inflar o saco antes da colisão? Na verdade, se trata de um gás que provém de uma reação química de decomposição. Veja como funciona:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no pára-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Alguns centésimos de segundo depois, o airbag está completamente inflado, salvando vidas, veja as equações do processo:
1. NaN3 → 2 Na + 3N2
2. 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
3. K2O + Na2O + SiO2 → silicato alcalino
A reação produz gás nitrogênio e silicato alcalino.
Os airbags complementam a função dos cintos de segurança, agindo conjunta e simultaneamente com o objetivo de reter o movimento dos ocupantes para frente em fortes colisões, eles fornecem uma proteção adicional reduzindo os riscos de ferimentos na cabeça e no tórax.
- sensores localizados na parte frontal do veículo;
- um dispositivo onde há substâncias químicas que reagem entre si quando recebem um impulso elétrico;
- uma bolsa plástica que fica acondicionada dentro do ponto central do volante de direção. No caso do passageiro, a bolsa está localizada no painel logo acima do porta-luvas.
Mas como a bolsa plástica se enche subitamente no caso de uma colisão? E de onde vêm os 70 litros de ar que faz inflar o saco antes da colisão? Na verdade, se trata de um gás que provém de uma reação química de decomposição. Veja como funciona:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no pára-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Alguns centésimos de segundo depois, o airbag está completamente inflado, salvando vidas, veja as equações do processo:
1. NaN3 → 2 Na + 3N2
2. 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
3. K2O + Na2O + SiO2 → silicato alcalino
A reação produz gás nitrogênio e silicato alcalino.
Os airbags complementam a função dos cintos de segurança, agindo conjunta e simultaneamente com o objetivo de reter o movimento dos ocupantes para frente em fortes colisões, eles fornecem uma proteção adicional reduzindo os riscos de ferimentos na cabeça e no tórax.
fonte:http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm
Assinar:
Postagens (Atom)