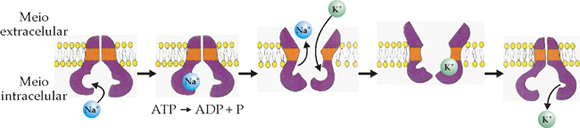
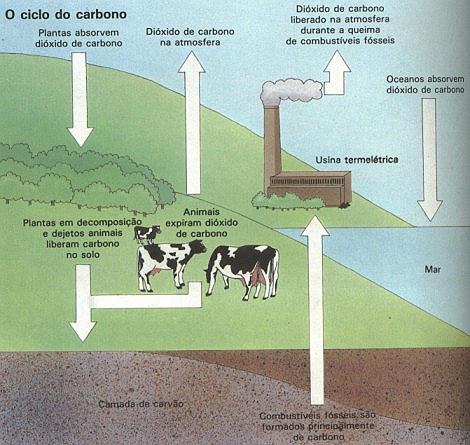
| ObjetivoCrescer vários tipos de cristais pelo método da solução supersaturada. |
| DescriçãoEsse é um projeto bastante demorado, podendo levar semanas ou meses. Portanto, só escolha essa sugestão se tiver bastante tempo até a data da Feira. No entanto, com jeito e paciência você poderá crescer cristais tão bonitos como esses vistos ao lado. E esses cristais servirão para vários outros projetos que descreveremos depois. Cristais podem ser crescidos artificialmente por várias técnicas. Vamos descrever, a seguir, como você pode crescer bons cristais pelo método de solução supersaturada. |  |
| Soluções supersaturadas.Um sal como o cloreto de sódio, nosso velho sal de cozinha, dissolve bem em água e a solução é transparente. Mas, se adicionarmos sal em quantidade muito grande, ultrapassando um certo valor dito "de saturação", a solução fica turva e o excesso de sal se deposita no fundo do vidro. Uma solução nesse estado é dita "supersaturada". O valor de saturação depende da temperatura da solução. Água quente dissolve melhor que água fria. Uma solução supersaturada na temperatura ambiente, pode voltar a ficar transparente se aquecida a 50 ºC, por exemplo. E aí, surge um fato novo. Deixando esta mesma solução resfriar lentamente, sem nenhuma agitação, ela pode voltar à temperatura ambiente e continuar transparente, sem precipitado. Nesse caso, a solução está a ponto de precipitar, em equilíbrio instável. Qualquer perturbação pode quebrar esse equilíbrio e a solução se turvar novamente. É exatamente essa instabilidade que se aproveita para o crescimento de cristais. Colocando um pequeno cristalzinho do mesmo sal nessa solução supersaturada, partículas do sal que estão prestes a se precipitar podem aderir às paredes do cristal, fazendo-o crescer. Esse cristalzinho é a "semente" de crescimento do cristal. Crescendo cristais em soluções supersaturadas. Para crescer cristais você precisará dos sais, de recipientes adequados, de água destilada, uma balança, um termômetro e um bocado de paciência. Os sais podem ser adquiridos em lojas de produtos químicos ou obtidos, no queixo, de seu professor de química ou de um professor da universidade mais próxima. Os recipientes podem ser vidros de geleia ou doce, de boca larga e tampa de enroscar. Consiga vários deles, de tamanhos diversos, e limpe-os com muito cuidado. Daremos, a seguir, receitas para o crescimento de vários tipos de cristais pelo método das soluções supersaturadas. Começaremos com o Alúmen que é um dos mais fáceis de crescer. É bom começar por ele para não perder a paciência e conseguir resultados encorajadores em pouco tempo. A receita para esse cristal será dada com mais detalhe. As demais são semelhantes. Alúmen (Sulfato de Alumínio e Potássio dodecahidratado) SOLUÇÃO SUPERSATURADA: 20 gramas por 100 mililitros de água. (1 ml = 1 cc) SAL ADICIONADO: 4 gramas por 100 mililitros de água. Preparando uma solução saturada. A melhor forma de preparar uma solução saturada é deixar uma solução supersaturada depositar seu excesso de sal no fundo do vidro. A quantidade de sal dada acima produz uma solução supersaturada a temperatura ambiente (27 ºC). Use, por exemplo, 400 ml de água destilada em um de seus vidros e ponha 80 g do sal nessa água, a temperatura ambiente. Mexa bem e observe que não consegue dissolver o sal completamente. Espere algumas horas até que todo o excesso se precipite e a solução fique clara. Essa solução está saturada pois seu excesso de sal se precipitou. Passe a solução para outro vidro, com cuidado para que o sal do fundo não vá junto. Cubra esse novo vidro para evitar evaporação. Retire o sal depositado, ponha-o em um pires limpo, espere que ele seque e guarde-o para uso futuro. Se algum cristalzinho bem formado aparecer nesse precipitado guarde-o para usar como semente. Preparando uma semente. |
| Uma semente pode ser preparada pondo um pouquinho de sua solução saturada em um vidro pequeno e deixando-a evaporar em um lugar seguro. Pequenos cristais se formarão no fundo desse vidro. Esses são candidatos a semente. Pegue-os com uma pinça e separe os melhores, sem defeitos e sem incrustações. A semente escolhida será amarrada na ponta de uma linha fina e resistente e pendurada em um cartão com 3 furinhos que deverá se ajustar completamente à tampa do vidro onde o cristal será crescido. Ajuste o cartão com a linha e a semente na parte interna da tampa e guarde para usar logo mais. |  |
| Crescendo o cristal.Agora você tem uma solução saturada e uma semente. Está pronto para crescer seu cristal. Aqueça a solução saturada até uns 50 ºC e dissolva nela a quantidade adicional de sal mencionada acima (4 g para cada 100 ml). Deixe esfriar sem mexer e, quando a solução estiver uns 3 ºC acima da temperatura ambiente, enrosque a tampa com a semente pendurada de modo que fique pelo meio do vidro. Pronto. Agora basta ter paciência e não perturbar o cristal enquanto cresce. O vidro de crescimento deve ficar em um lugar de temperatura constante e sem vibrações. Um armário que não é usado, em local abrigado, é uma boa pedida. Todo dia você pode dar uma olhadinha para ver como andam as coisas. Quando achar que o tamanho do cristal está bom, tire-o do vidro e seque-o em uma toalha de papel. Não é boa prática pegar o cristal com os dedos pois o suor pode corroer a superfície. Ha figura do início desta página, o alúmen é o cristal branco que está na mão, entre o dedo mindinho e o seu vizinho. |  |
| Outros cristais.Damos, a seguir as receitas para outros cristais. O procedimento geral é o mesmo que no caso do alúmen. Tartrato de Sódio e Potássio (Sal de Rochelle). SOLUÇÃO SUPERSATURADA: 130 g por 100 ml de água. SAL ADICIONADO: 9 g por 100 ml de água. Esse é um cristal bem fácil de crescer. Na figura do início é aquele cristal enorme e transparente que está atrás dos outros. Como ele cresce muito ligeiro às vezes fica difícil evitar aglomerações. Outro problema é que a solubilidade desse sal varia muito com a temperatura. Tente manter a temperatura do crescedor o mais constante possível. Um método que pode funcionar é colocar o vidro do crescedor dentro de um grande depósito com água, uma bacia, por exemplo. Ferricianeto de Potássio (Prussiato vermelho). SOLUÇÃO SUPERSATURADA: 46 g de sal por 100 ml de água. SAL ADICIONADO: alguns grãos. Também é fácil de crescer. Não se preocupe com o nome cianeto. Esse material não é tóxico. Mesmo assim, você não deve ingerílo, pois pode ter uma bela indisposição estomacal. Na figura, esse cristal é aquele vermelhão que fica na ponta do dedo do cotoco. Acetato de cobre monohidratado. SOLUÇÃO SUPERSATURADA: 10 g de sal por 100 ml de água. SAL ADICIONADO: alguns grãos. Esse é um cristal um pouco mais difícil de crescer que os anteriores. Como é muito bonito, vale a pena o esforço de crescê-lo. Na figura, é aquele cristal violeta que está bem na ponta do dedo mindinho. Acetato de cálcio e cobre hexahidratado. Esse cristal é formado com dois compostos: o óxido de cálcio e o acetato de cobre monohidratado, usado no cristal anterior. Use o seguinte processo. Ponha 22,5 g de óxido de cálcio em 200 ml de água, acrescente 48 g de ácido acético glacial e misture até ficar transparente. Se necessário, filtre a solução. Em outro vidro, dissolva 20 g de acetato de cobre em 150 ml de água quente. Misture as duas soluções em outro vidro, cubra e deixe descansar por 1 dia. A partir desse ponto, proceda como anteriormente. Esse é um belo cristal e vale a pena o esforço de crescê-lo. Na figura, é aquele cristal azul escuro que está bem na frente dos demais. |
| AnáliseO crescimento de cristais em solução supersaturada utiliza a dependência da solubilidade dos sais com a temperatura. O diagrama ao lado ajuda a entender o método usado. Ele representa uma curva de solubilidade típica para um sal. Na parte de baixo da curva, a solução tem pouco sal e é subsaturada. Todo o sal se dissolve, nesse caso. Na parte de cima, a solução é supersaturada: o sal não se dissolve totalmente e parte dele se precipita. A curva entre as duas regiões indica o estado de saturação. No método de crescimento descrito acima, começamos com uma solução subsaturada (ponto A). Aquecemos a solução levando-a para o ponto B, mais subsaturada ainda. Nessa temperatura, adicionamos sal levando a solução ao ponto C, ainda subsaturada. Deixando a temperatura cair gradualmente, a solução vai ao ponto D, onde deve estar supersaturada. É aí que se dá o equilíbrio instável que mencionamos acima. A solução está prenhe, no ponto certo de crescer um cristal. Nesse ponto você planta sua semente e espera alguns dias pelo seu rebento (não precisa esperar nove meses). |  |
| MaterialSais adquiridos em firmas de produtos químicos ou em algum laboratório de química de seu colégio ou da universidade mais próxima. Balança que meça gramas. Termômetro. Vários vidros de geleia ou doce, com tampas de enroscar. Água destilada. Toalhas e filtros de papel. Um aquecedor de algum tipo. O melhor mesmo é uma placa de aquecimento própria para laboratório, mas, o velho fogão da cozinha de sua casa pode quebrar o galho. Cuidado para não se queimar. |
| DicasNão coma esses sais nem beba as soluções! É claro que você não vai fazer uma besteira dessas, mas temos a obrigação de avisar. Durante todo a manipulação lave bem as mãos. Os sais costumam aderir à pele e contaminar as sementes, comprometendo todo o processo. Às vezes, a semente se dissolve na solução, em vez de crescer. Isso indica que a solução está subsaturada. Comece tudo de novo, usando um pouco mais de sal adicionado. Crescer cristais é como cultivar uma horta. Dá trabalho, exige paciência e uma boa mão mas, quando se pega o jeito, costuma-se ficar viciado. Leve suas soluções com cristais em crescimento para seu estande na Feira, além dos melhores cristais que cresceu e dos sais utilizados. Leve também uma lupa para mostrar detalhes de seus cristais. Referência Esse projeto foi inspirado pelo livro "Crystals and Crystal Growth", de Alan Holden e Phylis Singer. A figura com os cristais que mostramos no início foi tirada desse excelente livro. Como é uma publicação da Doubleday, de 1960, é improvável encontrá-lo nas livrarias. Talvez exista na biblioteca da Universidade mais próxima. Consulte também os mecanismos de busca da Internet. fonte: http://www.seara.ufc.br/sugestoes/fisica/espec1.htm |